2017년 항암면역치료제 분야에서 가장 주목받는 약물은 차세대 면역항암제로 불리는 키메릭 항원 수용체-T세포(Chimeric Antigen Receptor-T Cell, 이하 CAR-T)'다.
CAR-T는 B세포에 정보를 제공하여 항체 생성을 돕는 T세포의 수용체에 암세포 등 특이 항원을 인지하는 항체를 융합시켜 수용체의 식별능력과 T세포가 가진 살상능력을 합친 치료제다. 기존 항암제와 달리 한 번 투여만으로 지속적인 효과를 볼 수 있으며, 기존 약물과 병용치료가 가능할 뿐 아니라 더 이상의 치료법이 없는 종양 환자에 대한 치료효과가 높다는 특징이 있다.
이미 수많은 다국적 제약사들과 바이오텍들이 수많은 CAR-T 프로젝트를 진행 중이고, 글로벌 임상만 100여건에 이를 정도다. 이 중 임상 2상을 진행 중인 치료제도 6건에 달해, 올해 임상 결과 및 FDA 승인 신청 결과가 어떻게 나올지에 대해 전세계 제약·바이오 업계 관계자들의 이목이 집중되고 있다.
투약 범위 대폭 넓힌 세포치료제
CAR-T가 기존 세포 치료제와 차별화되는 점은 MHC 항원에 비특이적 특징을 가지고 있다는 것이다.
일반적인 T세포 치료제는 T세포 수용체(T Cell Receptor, 이하 TCR)가 종양세포 표면의 항원을 인식하도록 조작하는 것을 골자로 한다. 이 때 TCR이 인식하는 것은 항원표시물질인 MHC(Major Histocompatibility Complex) 단백질이다. MHC는 마치 지문처럼 사람마다 조금씩 다르며, 피부·장기 이식 등의 과정에서 면역 거부를 결정짓는 가장 중요한 인자다. TCR에서 MHC를 인지한 후 자신의 세포가 아니라고 판명하면, T세포는 해당 세포를 공격·파괴하는 방식이다.
여기서 TCR이 종양세포의 항원을 제대로 인식하게 만들려면 종양세포의 MHC만을 인식해 제거하도록 조작해야 한다. 암세포만을 인식해 정확히 공격할 수 있다는 장점이 있지만, TCR-MHC간 상호 작용만으로 상용화하기에는 효율 및 지속성 면에서 큰 효과를 거두지 못했다. 또한 종양에 따라 MHC와 TCR의 반응성이 다르기 때문에 적용 가능한 환자 수도 한정돼 있었다.
CAR-T는 이러한 문제를 개선했다. 종양세포 항원 인식을 TCR-MHC 간 상호 작용에 맡기는 것이 아니라, 바이러스 벡터를 활용해 종양세포 표면의 특정 단백질 항원을 직접 인식하는 키메릭 수용체(Chimeric Antigen Receptor, CAR)를 발현시켜 종양세포를 강력하게 인식한다.
이렇게 만들어진 CAR-T는 환자 개별적인 MHC 반응성 차이에서 비교적 자유롭다. 실제로 프랑스의 셀렉티스사는 유전자 가위 CRISPR-Cas9를 통해 T세포의 TCR을 제거해 투약 범위를 대폭 넓힌 CAR-T를 개발 중이다.
또한, CAR 수용체에 T세포를 활성화시키는 보조인자를 부착해 체내에 오래 머무르며 암세포를 살상하는 이른바 '살아있는 약물'이 되어 한 번 투여만으로 오랜 시간 효과를 볼 수 있는 점이 특징이다. 현재 상용화된 '이뮨셀LC' 등의 사이토카인 유도 살해세포(CIK, cytokine-induced killer) 성분의 T세포 기반 면역항암제가 16회에 걸쳐 주사해야 하는 것에 비해 투약 횟수를 현저히 줄일 수 있을 것으로 기대되는 부분이다.
CAR-T 개발 선도 노바티스·카이트·주노
CAR-T 치료제는 1980년대 후반 처음 만들어졌지만, 주목을 받기 시작한 것은 CAR-T 연구의 선두 주자로 알려진 美 펜실베니아대 칼 준(Carl June) 교수팀의 2011년 임상 결과부터다. 당시 임상에서는 3명의 말기 만성림프성백혈병 환자에 CAR-T 세포를 주입했으며, 그 중 2명에게서 10개월 간 완치 효과가 지속되는 것이 확인됐다.
이후 전세계에서 CAR-T 치료제에 대한 연구가 활발히 진행됐고, 유방암이나 폐암 등의 고형암에서는 종양 조직에서 분비되는 T세포 활성저하인자 등으로 인해 효율이 낮지만 백혈병 등의 혈액암에서 획기적인 효과가 있다는 연구 결과가 계속해서 전해졌다.
현재 노바티스는 만성 및 급성 림프구성백혈병에 대한 CAR-T의 임상 2상을 진행 중이며, 카이트파마는 만성림프구성백혈병과 B세포림프종 임상 1, 2상을, 주노테라퓨틱스는 급성림프구성백혈병과 비호지킨성림프종의 임상 1, 2상을 각각 진행했다. 위에 언급한 노바티스와 카이트파마, 주노테라퓨틱스 3사는 CAR-T 연구에서 선두를 달리고 있는 업체들로, 임상 결과에 대해 전세계 업계 관계자들의 관심이 쏠려 있는 상태다.
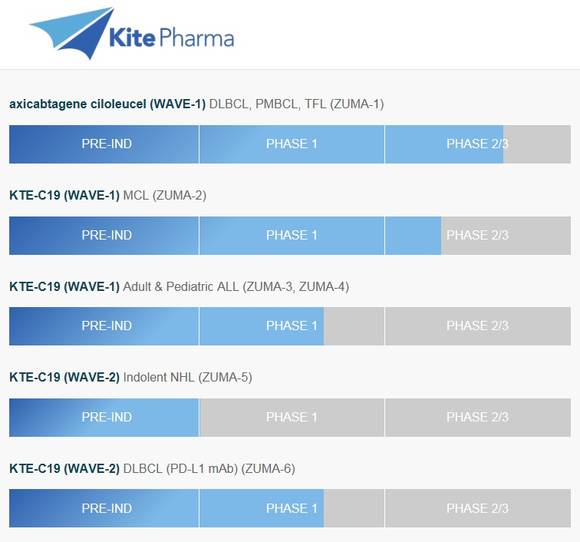
▲카이트파마 CAR-T 치료제 개발 현황
미국 바이오업체인 카이트파마에서 개발 중인 CAR-T 치료제 'KTE-C19'는 현재 자가 조혈모세포 이식이 부적합하고 진행이 빠른 재발성 및 불응성 B세포 비호지킨 림프종 환자를 위한 치료제로 FDA 허가신청서 제출을 앞두고 있다. 'KTE-C19' 허가 신청서는 올해 3월 경 미국 성분명 액시캡타진 실로루셀(axicabtagene ciloleucel)로 제출이 완료될 예정이며, 승인이 떨어질 경우 올해 내 출시되어 미국 최초의 상용화된 CAR-T 치료제로 기록될 전망이다. 미국 외에도 유럽의약품청 EMA에 대한 승인신청서도 올해 안에 제출 예정이다.
한편, 주노 테라퓨틱스의 CAR-T 치료제 'JCAR015'는 CRS 증상(Cytokine Release Syndrome, 사이토카인 방출증후군)으로 인해 지난 11월말 임상을 중단했다. CRS는 CAR-T 치료제에서 빠지지 않고 언급되는 가장 큰 부작용이다. CAR-T 치료제는 T세포 증식 및 활성화 과정에서 보조물질을 투여하게 되는데, CRS는 이 과정에서 T세포의 면역이 과다하게 일어나 면역단백질인 사이토카인을 과다하게 분비하는 것이다.
CRS가 보고될 경우 고열과 혈압 감소, 호흡곤란 등이 잇따른다. 심할 경우 뇌부종(Cerebral Edema)에 빠질 수 있다. 주노테라퓨틱스의 'JCAR015'는 지난 7월 3명의 환자가 뇌부종으로 사망했으며, 문제 원인으로 지목된 전처리 항암제를 뺀 후기 임상에서도 뇌부종으로 2명의 환자가 사망했다. 다만, JCAR017을 포함한 다른 CAR-T 후보물질들이 남아 있어 CAR-T 파이프라인의 성공 여부를 판단하기엔 이르다.
국내 제약사들도 CAR-T 치료제 개발에 한창이다. 녹십자셀과 녹십자랩셀은 'CAR-T'와 'CAR-NK' 치료제를 개발 중이며, 유한양행은 미국 면역항암제 전문 개발사인 소렌토 테라퓨틱스와 손잡고 세운 합작투자회사 이뮤노시아(Immunocia)를 통해 CAT-T 기술 기반 면역항암제 후보물질의 임상시험을 추진 중이다. 바이오 의약품 개발 전문기업 바이로메드 역시 지난 2015년 12월 전임상단계에 있는 CAR-T 기술을 미국 바이오업체 블루버드바이오에 기술 이전하는 4800만달러 규모의 계약을 체결한 바 있다.
류종화 기자의 전체기사 보기
Copyright @보건신문 All rights reserved.