2019년 한 해 동안 미국 FDA가 허가한 신약은 총 48건으로, 2018년 59건에 비해 18.6%(11건)가 감소했다.
생명공학정책연구센터의 BioINwatch 보고서에 따르면, 미국 FDA 의약품평가센터(CDER)의 2019년 신약 승인 건수는 총 48건으로, 2017년 46건, 2018년 59건에 이어 꾸준히 많은 신약을 허가했다.
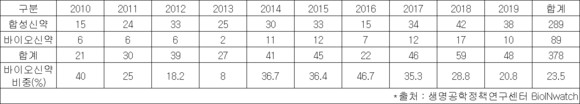
승인된 신약 중 바이오신약은 10개로 약 21%이며, 2010년~2019년 누적 승인 신약에서 바이오신약의 비중은 23.5%로 20%대를 점유했다.
지난해 허가된 신약의 44%는 희귀의약품, 42%는 혁신신약으로, 새로운 영역에서 환자를 치료하는 다양한 신약들이 허가받았다.
의학적 미충족 요구를 충족시키거나 환자의 치료를 진전시키는데 도움이 되는 혁신적인 의약품을 승인받았다.
48건의 신규허가 중 21건이 희귀의약품 지정을 받은 신약으로, 낭포성 섬유증, 겸상적혈구질환, 시신경척수염, 전신경화증 관련 간질성폐질환(SSc-ILD) 등의 치료제가 승인받았다.
승인된 신약 48개 중 42%인 20개가 혁신신약(First-in-class)으로 승인받았다.
44%인 21개는 희귀질환 치료제이며, 신속한 개발 및 승인을 촉진하기 위한 신속심사, 우선심사 등의 규제경로를 적극 활용했다.
48건 중 17건는 신속심사로, 13건은 획기적 치료제로 지정받았으며 28건은 우선심사 대상으로, 9건은 가속승인 대상으로 지정됐다.
48건 중 33건(69%)은 다른 국가에서 승인받기 전에 미국에서 최초로 승인됐으며, 43건(90%)은 최초허가신청서로 승인받았다.
승인된 신약의 개발사로는 노바티스가 5건으로 가장 많은 신약을 승인받았으며, 애비브, 다이이찌산쿄, 제네텍(로슈가 인수)은 각각 2건의 신약을 승인받았다.
임중선 기자의 전체기사 보기
Copyright @보건신문 All rights reserved.