국회 보건복지위원회(위원장 양승조)가 지난 7일 국회에서 연 식품의약품안전처 국정감사는 한마디로 한미약품의 성토장이라 할 정도로 처음부터 끝까지 한미약품의 부도덕성을 성토하는 의원들의 질타로 긴장감이 맴돌았다.
국회 보건복지위원회(위원장 양승조)가 지난 7일 국회에서 연 식품의약품안전처 국정감사는 한마디로 한미약품의 성토장이라 할 정도로 처음부터 끝까지 한미약품의 부도덕성을 성토하는 의원들의 질타로 긴장감이 맴돌았다. 한미약품에 대한 질의는 천정배 국민의당 의원(보건복지위, 광주 서구을)이 포문을 열었다. 천정배 위원은 한미약품의 폐암 신약 ‘올리타정’이 임상시험에서 환자가 부작용으로 사망한 사실을 알고도 고의로 보고를 누락시킨 채 신약 허가를 신청했다는 의혹을 제기했다.
천 의원은 “한미약품의 지연보고는 올리타정의 조건부 허가가 원인 무효가 될 만큼 중대한 범죄행위”라며 “허가 승인 이후 한미약품의 부작용 은폐 행위가 원인이 되어 환자들이 부작용 위험에 노출된 부분에 대해서는 민형사상 책임을 물어야 할 것”이라고 말했다.
천 의원은 또 한미약품이 폐암신약 ‘올리타정’ 임상시험 2단계에서 사망환자가 발생했는데도 이를 누락한채 ‘3상 조건부 허가’ 신청을 했고, 식약처는 지난 5월 13일 이를 승인했다고 주장했다. 이후 한미약품은 지난 9월 1일 조건부 허가 당시에 보고하지 않았던 15년 7월 4일 환자 사망 사건을 1년이 지나서야 ‘올리타정’의 약물 이상반응으로 후속 보고했다고 질타했다.
이후 식약처는 신규 환자의 잠정 사용 제한과 기존 투약중인 환자의 제한적 사용을 권고하는 안전성 서한을 지난 9월 30일 배포한데 이어 한미약품 사건에 대한 정확한 진상규명 없이 지난 4일 중앙약사심의위원회를 개최하여 신규 환자의 잠정 사용 제한 조치를 철회했다고 목소리를 높였다. 안전성 서한을 배포한데는 한달을 끌다가 안전조치를 철회하는데는 (1~3일이 연휴인 점을 감안할 때) 불과 하루밖에 안걸렸다고 주장했다.
이에 손문기 식약처장은 “한미약품이 (환자사망 사건을) 작년에 보고할때는 의심사료로 보고한 것이었고 식약처에 보고된 것이 인과관계가 명백하게 밝혀진 지난 9월 1일이었다”면서 “검토결과 명백하다고 생각해서 지난 9월 30일 선 조치 후 지난 4일 환자의 동의를 받은 후 사용토록 했다”고 해명했다.
이어서 박인숙 새누리당 의원(서울 송파구갑)은 “이번 한미약품의 파트너사인 독일 제약사 베링거인겔하임의 올무티닙 임상 중단 결정은 임상시험 환자의 사망 보다는 올리타정의 경쟁 제품인 타그리소(아스트라제네카 개발)의 임상 3상 결과 성공에 기인한 것”이라면서 “경쟁회사에 비해 타이밍이 늦어 아까운 기회를 놓친 만큼 관련 규제를 과감히 제거해 불필요한 시간을 허비하는 일이 없도록 해야 한다”고 주장했다.
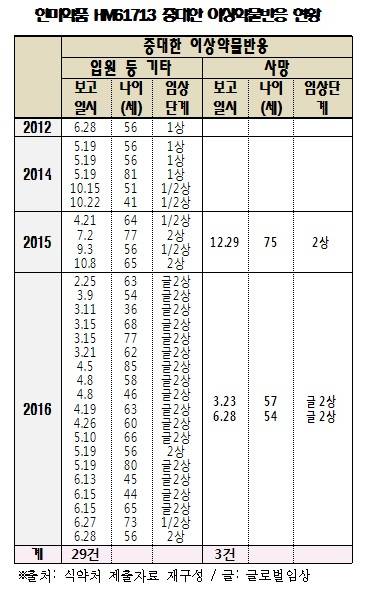 올리타정 부작용으로 사망한 사례가 식약청의 발표와는 달리 5건이라는 의혹이 제기되기도 했다. 권미혁 더불어민주당 의원(비례대표)이 “식품의약품안전처를 통해 받은 자료를 확인한 결과, 한미약품 올리타정으로 인한 사망자가 3명, 중대한 이상약물반응이 29건에 이르는 것으로 확인했다”고 밝혔다. 권미혁의원이 확인한 자료에 의하면 2015년 12월 29일(75세), 2016년 3월 23일(57세), 2016년 6월 28일(54세) 각각 사망자가 발생한 것으로 조사됐다.
올리타정 부작용으로 사망한 사례가 식약청의 발표와는 달리 5건이라는 의혹이 제기되기도 했다. 권미혁 더불어민주당 의원(비례대표)이 “식품의약품안전처를 통해 받은 자료를 확인한 결과, 한미약품 올리타정으로 인한 사망자가 3명, 중대한 이상약물반응이 29건에 이르는 것으로 확인했다”고 밝혔다. 권미혁의원이 확인한 자료에 의하면 2015년 12월 29일(75세), 2016년 3월 23일(57세), 2016년 6월 28일(54세) 각각 사망자가 발생한 것으로 조사됐다.식약처는 보도자료를 통해 “임상시험 중 이 약과 관련이 있는 ‘중대한 이상약물반응’으로 사망한 사례는 기존에 식약처가 발표한 사례와 동일한 것으로써 한 건 뿐”이라면서 “나머지 두건의 사례는 해당 약물과 인과관계가 없는 것으로 최종 확인됐다”고 밝혔다. 권미혁 의원이 주장한 15년 10월에 발생한 중증이상약물반응은 간질성 폐질환으로 폐암이 진행되어 사망했고 16년 6월 중증이상약물반응 사례는 패혈증으로 최종조사 결과 약과 인과관계가 없다는 것이다. 또한 29건 중증이상약물반응(사망사례제외)은 심한 발열이나 구토 등으로 입원 등이 필요한 사례로 중증이상약물반응으로 보고되었으나 모두 회복됐다고 설명했다.

▲한미약품과 베링거인겔하임이 DMC에 보낸 서한
정춘숙 더불어민주당 의원(비례대표)은 “베링거인겔하임이 한미약품에 올무티닙 기술 수출 계약 해지를 공식 통보하기 전인 지난 8월 23일 올무티닙의 글로벌 임상 2상시험을 중단하기로 결정했다는 문서를 보냈다”면서 “이를 감안할 때 한미약품이 올무티닙의 임상 부작용을 공시 한 달 전 알고도 의도적으로 은폐했다”고 주장했다.
정 의원은 한미약품과 베링거인겔하임이 지난 8월 23일 임상시험 절차를 관리하는 전문가 기구 ‘데이터 모니터링 위원회(DMC)’에 보낸 서한을 공개했다. 서한에는 “모든 피험자 모집은 중단한다. 베링거인겔하임은 더 이상 임상을 진행하지 않겠다”는 내용이 들어있다. 정의원은 “공식적으로는 베링거인겔하임이 지난 9월 29일 계약을 취소한다고 이메일을 보냈다고 하지만 이미 한 달 전인 지난 8월 23일 베링거인겔하임은 포기할 뜻을 한미약품 측에 전달한 것으로 보인다”고 주장했다.
이에 대해 한미약품은 “글로벌 시장에 변화가 생김에 따라 임상시험 계획을 잠시 중단하기로 하고 이를 DMC에 알린 것”이라고 해명했다.
강성기 기자의 전체기사 보기
Copyright @보건신문 All rights reserved.