프랑스, 만성중증 설사 등 의약품 명단서 삭제
올메사르탄 ‘중증 장질환’ 위험 주의
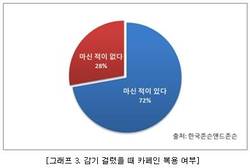
식약처가 고혈압치료제인'올메사르탄' 제제를 사용할 때 중증설사, 체중감소 등 부작용에 주의를 기울여야 한다고 밝혔다.식품의약품안전처(처장 손문기)는 ‘올메사르탄’ 함유제제에 대해 프랑스 국립의약품청(ANSM)이 효과 미흡, 장질환 발생 위험성 등으로 인해 의약품 명단에서 삭제할 것이라고 발표함에 따라 국내 의약전문가 및 소비자 단체 등에 안전성 서한을 배포한다고 밝혔다.올메사르탄 단일제는 본태성 고혈압 치료, 복합제는 각 성분의 단독요법으로는 혈압이 조절되지 않는 본태성 고혈압 치료에 사용된다.프랑스 국립의약품청(ANSM)’은 올메사르탄‘ 관련 제제에 대한 약물감시 등을 검토한 결과 △심근경색, 뇌졸중 등 심혈관 질환이나 사망률 감소 효과 미흡 △‘중증 장질환’ 위험에 따른 상당한 체중감소, 급성신부전을 동반한 만성 중증 설사, 소화계 합병증 발현 위험성의 원인 등으로 3개월 후 허가 의약품 명단에서 삭제하기로 최종 결정했다. 현재 ‘올메사르탄’ 함유제제는 미국, 일본, 다른 유럽 국가에서 사용되고 있으며, 국내에는 ‘올메사르탄’ 단일제로 한국다이찌산쿄(주) 올메액트정10밀리그램 등 140개 제품이 허가돼 있고 ‘올메사르탄’ 복합제로 한국다이찌산쿄(주) 세비카정 10/20밀리그램 등 181개 제품이 허가돼 있다.식약처는 국내 허가된 해당 제품의 사용 시 주의사항에는 ‘중증 장질환’ 위험에 대한 내용이 반영돼 있으며, 향후 프랑스 보건당국의 조치, 국내 전문가 자문 등 검토 절차를 거쳐 필요한 안전 조치를 취할 계획이라고 밝혔다.또 국내 의·약사 등에게는 해당 제품을 환자에게 처방·투약 시 사용 상 주의사항 등을 참고해 줄 것을 당부했다.
2016/04/12